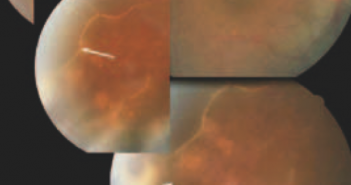
DMLA : l’intérêt d’un test quantitatif de sensibilité aux contrastes
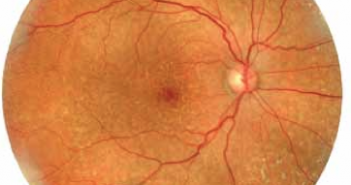
L’étude publiée en novembre par cette équipe de Boston visait à corréler les résultats d’un test fonctionnel, la sensibilité aux contrastes (qCSF), avec l’imagerie, i.e. les marqueurs OCT d’évolutivité de la DMLA intermédiaire.
Pour mémoire, le terme américain de “DMLA intermédiaire” correspond à une maculopathie liée à l’âge à un stade critique, comportant des drusen séreux (> 125 µm) et/ou des migrations pigmentaires maculaires [1]. Les résultats de l’étude suggèrent que la qCSF peut être corrélée avec le risque de progression de la DMLA intermédiaire vers l’atrophie géographique ou la DMLA néovasculaire.