Qu’avons-nous appris des dernières études du DRCR net sur la rétinopathie diabétique ?
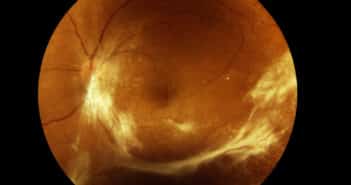
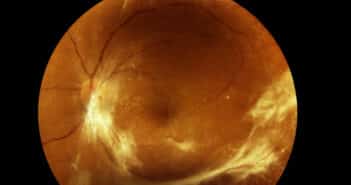
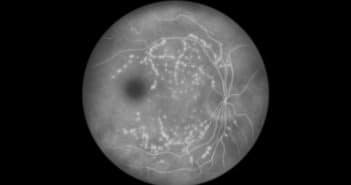
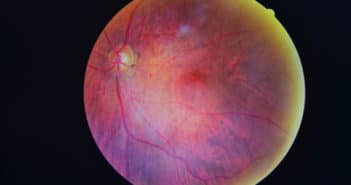
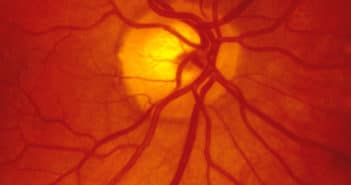
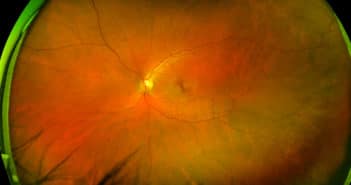
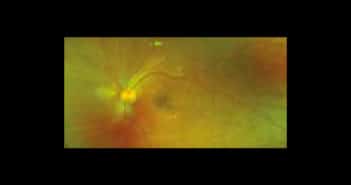
Les protocoles cliniques du DRCR net nous permettent d’adapter nos pratiques au cours du suivi et du traitement de la rétinopathie diabétique (RD). Les études les plus récentes mettent en exergue l’importance de l’imagerie ultra-grand champ dans cette indication et notamment l’angiographie à la fluorescéine pour affiner le risque évolutif des patients. Par ailleurs, la photobiomodulation n’apparaît pas comme une option thérapeutique des œdèmes maculaires diabétiques (OMD) sans baisse visuelle, mais dans cette indication, les injections intra-vitréennes d’aflibercept n’offrent pas non plus de résultat visuel supérieur à deux ans comparativement à une simple surveillance. Enfin, dans la prévention de l’évolution de la RD, en cas de rétinopathie diabétique non proliférante (RDNP) sans OMD, là encore les injections d’aflibercept n’améliorent pas les résultats visuels à quatre ans.