Heier JS, Khanani AM, Quezada Ruiz C et al.; TENAYA and LUCERNE Investigators. Efficacy, durability, and safety of intravitreal faricimab up to every 16 weeks for neovascular age-related macular degeneration (TENAYA and LUCERNE): two randomised, double-masked, phase 3, non-inferiority trials. Lancet, 2022 [ePub ahead of print].
Le faricimab est un anticorps bispécifique qui inhibe le VEGF (vascular endothelial growth factor) et l’angiopoïétine-2 (Ang-2). Le médicament est administré en intravitréen et vise à traiter les phénomènes exsudatifs associés aux néovaisseaux maculaires de la dégénérescence maculaire liée à l’âge (DMLA) [1], l’œdème maculaire diabétique (OMD) [2] et l’œdème associé aux occlusions veineuses.
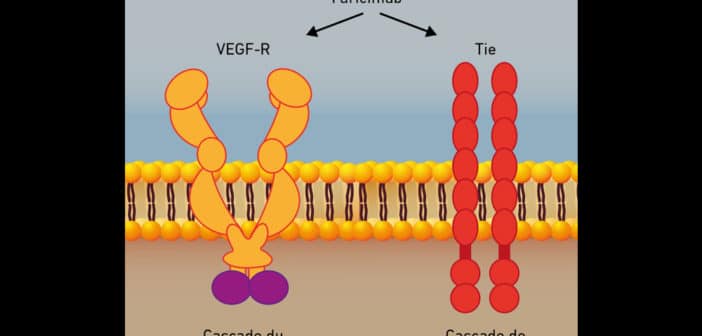
La majorité des ophtalmologistes ont découvert l’angiogenèse au milieu des années 2000 avec l’avènement du bévacizumab et du ranibizumab. Le système du VEGF et de ses récepteurs a fait l’objet d’une communication importante dans notre spécialité. Le système de l’angiopoïétine (Ang) et de ses récepteurs (Tie) constitue un deuxième mécanisme d’activation des récepteurs tyrosine kinase spécifiques des tissus vasculaires (fig. 1). La signalisation Ang-Tie est essentielle pendant l’assemblage et la maturation des vaisseaux embryonnaires, et fonctionne comme un régulateur clé de l’homéostasie vasculaire adulte [3].
L’étude publiée ce mois-ci dans le Lancet rapporte les résultats de deux essais de phase III évaluant le faricimab administré en injection intravitréenne avec un intervalle étendu jusqu’à 16 semaines pour le traitement des néovaisseaux de la DMLA.
Les études TENAYA et LUCERNE étaient des essais de non-infériorité randomisés, en double insu, menés sur 271 sites. Les patients âgés de 50 ans ou plus atteints de DMLA néovasculaire et n’ayant jamais reçu de traitement ont été répartis de manière aléatoire (1:1) entre le faricimab intravitréen 6 mg toutes les 16 semaines maximum, en fonction des évaluations de l’activité de la maladie définies par le protocole aux semaines 20 et 24, et l’aflibercept 2 mg toutes les 8 semaines.
Le critère d’évaluation principal était la variation moyenne de l’acuité visuelle (meilleure acuité visuelle corrigée [BCVA]) par rapport à la ligne de base, calculée sur les semaines 40, 44 et 48 (marge de non-infériorité spécifiée à l’avance de 4 lettres). Les analyses de la sécurité ont inclus les patients ayant reçu au moins une dose du traitement de l’étude.
Dans les deux essais, 1 329 patients ont été assignés aléatoirement entre le 19 février et le 19 novembre 2019 (TENAYA : n = 334 faricimab et n = 337 aflibercept ; LUCERNE : n = 331 faricimab et n = 327 aflibercept). La variation de la BCVA par rapport[...]
Connectez-vous pour consulter l'article dans son intégralité.
Vous êtes abonné(e)
IDENTIFIEZ-VOUS
Pas encore abonné(e)
INSCRIVEZ-VOUS
Inscrivez-vous gratuitement et profitez de tous les sites du groupe Performances Médicales
S'inscrire