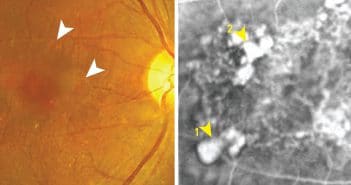
Polypes ou enchevêtrements vasculaires ?
Bo Q, Yan Q, Shen M et al. Appearance of…

Bo Q, Yan Q, Shen M et al. Appearance of…

Cette année, un mot ou plutôt deux dans la bouche…

L’endophtalmie est un effet indésirable oculaire grave, pouvant être observée dans les suites d’injections intravitréennes (IVT). Ce tableau peut-être confondu initialement avec celui d’un syndrome inflammatoire post-injections, et son incidence se situe entre 0,019 et 0,067 % d’après la littérature ces dernières années. Il est à noter que les germes impliqués dans l’endophtalmie sont ceux classiquement retrouvés dans la flore conjonctivale.
De nombreuses données issues des études cliniques, d’études rétrospectives ou d’analyses de bases de données apportent des informations sur le risque d’endophtalmie. Cet article fait la synthèse de ces données et de la survenue des endophtalmies post-injections intravitréennes : leur incidence, les causes et comment réduire ce risque.
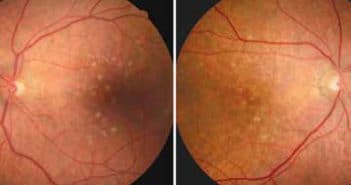
L’apparition d’un œdème maculaire chez un patient d’un âge avancé…
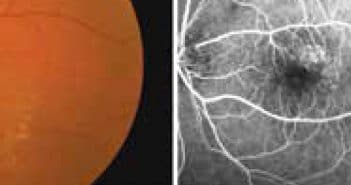
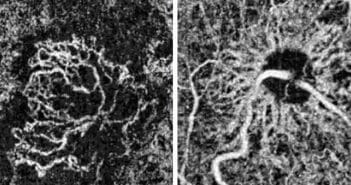
L’OCT-angiographie permet de mettre en évidence d’une manière non invasive le flux
circulatoire dans les vaisseaux du fond d’œil. Elle peut remplacer les angiographies à la fluorescéine et en infrarouge par un examen détaillé des segmentations, au niveau des plexus rétiniens et de la choriocapillaire, à la condition que l’hypersignal soit détectable. La segmentation sans artéfact sur la rétine externe montre les zones d’hypersignal détectables facilement dans les formes néovasculaires de DMLA type 2 et 3.
Cette imagerie non invasive et multimodale peut facilement être incluse dans le suivi si l’hypersignal est interprétable.
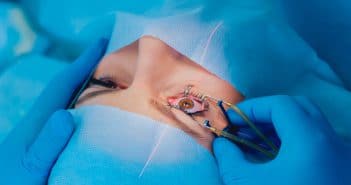
Les molécules administrées en injections intravitréennes (IVT) sont représentées par les corticoïdes et les anti-VEGF. L’avènement de ces molécules a révolutionné le pronostic fonctionnel de plusieurs pathologies rétiniennes.
Cependant, elles peuvent entraîner une hypertonie oculaire (HTO) immédiate (anti-VEGF) ou retardée (anti-VEGF et corticoïdes). Le risque d’HTO immédiate après IVT d’anti-VEGF est évalué à 3 à 12 % des patients avec un effet cumulatif des IVT. Le risque d’HTO retardée > 25 mmHg après injection d’un implant de dexaméthasone est, selon les pathologies traitées, de 11 à 32 % à 3 ans. Ces HTO sont réversibles après l’introduction ou l’intensification d’un traitement hypotonisant, et moins de 1 % sont réfractaires et nécessitent le recours à la chirurgie filtrante.
Les patients glaucomateux représentent une population à risque : un bilan doit être réalisé (imagerie des fibres et champ visuel). Une HTO et un glaucome mal contrôlés ou avec menace du point de fixation sont des contre-indications à l’injection d’un implant de dexaméthasone. Après une première IVT de corticoïde, le rythme de surveillance de PIO est recommandé entre 1 et 2 mois après l’IVT (et 8e jour en présence de facteur de risque), puis tous les 2 mois après chaque IVT ultérieure.

Takasago Y, Shiragami C, Kobayashi M et al. Macular atrophy…
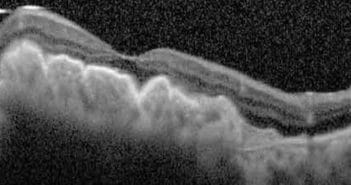
Van Romunde SHM, Polito A, Peroglio Deiro A et al.…
Pour prendre en charge un décollement de l’épithélium pigmentaire, une preuve irréfutable de la présence d’un lacis néovasculaire, soit par angio-OCT soit par angiographie, doit être apportée étant donnés la durée et le côté invasif du traitement.
Sur le plan thérapeutique, il semblerait qu’il n’y ait pas de bénéfice sur l’acuité visuelle à assécher complètement le DEP, mais il semble important de contrôler les signes exsudatifs surtout les logettes de mauvais pronostic en rapprochant les injections, en choisissant un schéma proactif et en switchant en cas d’une réponse sous-optimale.
Il semble avant tout que l’évolution défavorable des DEP à long terme soit liée à la fibrose et l’atrophie.
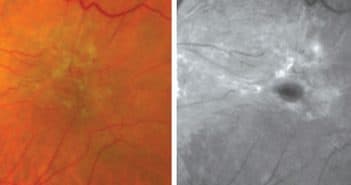
Les membranes épirétiniennes représentent la pathologie chirurgicale maculaire la plus fréquente. Leur détection précoce par les examens d’OCT systématiques soulève la question de l’indication opératoire. Si la conservation de l’acuité visuelle fait sursoir à toute chirurgie, l’indication chirurgicale ne doit plus attendre de baisse d’acuité visuelle importante.
L’amélioration des techniques chirurgicales et la diminution du risque de décollement de rétine invite à opérer les MER dès 6/10e afin d’offrir la meilleure réhabilitation visuelle.
