Editorial
La myopie forte, définie par une erreur réfractive inférieure à…

La myopie forte, définie par une erreur réfractive inférieure à…
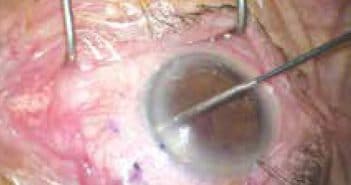
Après 50 ans d’une technique aussi établie que la trabéculectomie pour la chirurgie des glaucomes, de nouvelles procédures chirurgicales ont vu le jour ces dernières années, les MIGS
(Minimally Invasive Glaucoma Surgery).
Elles ambitionnent un meilleur profil de sécurité que la technique de référence mais aussi, pour certaines d’entre elles, une efficacité similaire en termes de baisse pressionnelle.
Nous rapportons ici les réflexions émanant de plus de 400 cas en deux ans de l’un de ces nouveaux procédés, le microstent gel XEN.
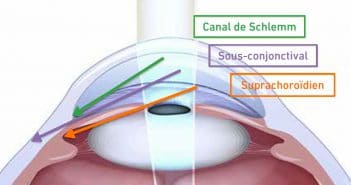
Les chirurgies mini-invasives du glaucome sont des techniques novatrices et récentes qui permettent de proposer de nouvelles options thérapeutiques aux patients glaucomateux. Elles sont multiples, tant par le type de dispositif utilisé, la voie d’abord chirurgicale proposée, ainsi que par les résultats sur la baisse pressionnelle et les complications per- et postopératoires possibles. L’objectif de cet article est de les présenter, de décrire les techniques chirurgicales, les résultats et surtout les atouts et les limites de chacune d’entre elles.
Nous souhaitons vous démontrer que les MIGS ont une vraie place dans l’arsenal thérapeutique du glaucome. Elles complètent les chirurgies traditionnelles et surtout, grâce à leur caractère
mini-invasif, elles permettent d’opérer des patients peu éligibles classiquement à la chirurgie tels que des glaucomes débutants ou au contraire des glaucomes avancés ou multi-opérés.
Au cours des 10 dernières années, la chirurgie du glaucome,…
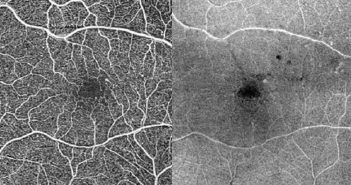
L’OCT-A permet par un examen non invasif de la rétine une analyse de la structure et de la localisation des anomalies vasculaires associées à la rétinopathie diabétique (RD) : microanévrismes, anomalies microvasculaires intrarétiniennes (AMIR), et néovaisseaux prérétiniens. De plus, grâce à de nombreux indices, il permet d’évaluer de façon quantitative la perfusion maculaire.
La plupart des études s’entendent sur le fait qu’il existe un lien entre l’état du réseau vasculaire maculaire et le stade de la RD. Les mesures de la zone avasculaire centrale (ZAC) présentent un niveau de corrélation faible avec le stade de la RD. Alors qu’il semblerait que la densité vasculaire soit davantage corrélée, même s’il existe une discordance entre les études sur la nature de l’indice le plus performant. Ces outils ne se substituent pas encore aux méthodes standardisées recommandées par la classification ETDRS (rétinographies), d’autant plus que les mesures en OCT-A ne nous fournissent pas de valeurs seuils spécifiques de chaque stade de l’ETDRS. Des avancées dans ce domaine sont donc nécessaires avant de pouvoir éventuellement classer, diagnostiquer et suivre la RD en s’affranchissant de l’évaluation du fond d’œil par rétinographie.
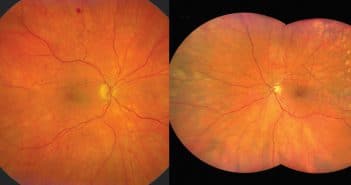
Ces dernières années ont vu se développer l’utilisation de l’imagerie ultra grand champ du fond d’œil qui s’impose progressivement dans de nombreuses pathologies rétiniennes dont les maladies vasculaires et tout particulièrement la rétinopathie diabétique. La possibilité d’accéder avec une facilité déconcertante à la rétine périphérique permet de mieux analyser les lésions avec un champ d’exploration de 200° soit une exploration de plus de 80 % de la rétine.
L’angiographie en fluorescence met en évidence l’étendue des territoires de non perfusion ou la présence de néovaisseaux prérétiniens non accessibles avec des appareils standards.
Le diagnostic de la rétinopathie diabétique est amélioré et de nombreuses publications viennent montrer l’intérêt de cette nouvelle technique d’imagerie qui pourrait à terme, modifier les classifications et optimiser la prise en charge des patients diabétiques.

Il y a quelques années l’arrivée des anti-VEGF nous a…

Les modifications cytogénétiques des mélanomes sont fortement corrélées au pronostic vital. Ainsi en cas de monosomie 3 intratumorale la survie est abaissée à 30 % à 5 ans. Le gain des fragments 8q et 6q sont aussi péjoratifs, probablement liés à suractivation de pro-oncogène. Au contraire, la présence d’un fragment 6p surnuméraire est de meilleur pronostic.
L’étude des mutations génétiques des mélanomes uvéaux permet d’identifier deux populations, la classe 1 est associée à une survie de 95 % à 92 mois alors que la classe 2 passe à 31 % de survie sur la même période.
Enfin, les mutations retrouvées sont différentes pour les mélanomes cutanés et uvéaux, ainsi les traitements ciblés sur la mutation BRAF ne peuvent être utilisés dans le traitement des métastases des mélanomes uvéaux.
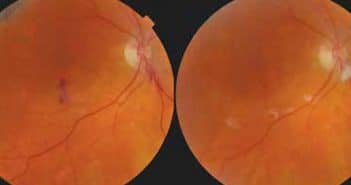
Les complications radiques oculaires ne surviennent pas uniquement après traitement radiothérapique des tumeurs oculaires ou orbitaires. Elles compliquent toute radiothérapie céphalique (ORL, cérébrale, maxillo-faciale) comprenant l’œil dans son champ d’irradiation. La plupart de ces complications sont prévisibles avec un effet dose-dépendant. Il convient de les prendre en charge de façon adaptée afin de ne pas ternir un peu plus le pronostic fonctionnel oculaire.
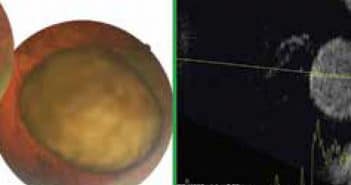
Le traitement du mélanome uvéal est le plus souvent conservateur par protonthérapie ou brachythérapie. Les complications radiques sont d’autant plus fréquentes que la tumeur possède des dimensions importantes. Pour certains de ces cas, une endorésection peut se concevoir afin d’éviter la redoutable complication qu’est le glaucome néovasculaire.
La chirurgie a pour but de supprimer les facteurs toxiques largués par la tumeur après radiothérapie. La chirurgie d’endorésection est une chirurgie oculaire complexe avec un potentiel de complications précoces qu’il faut savoir reconnaître et prendre en charge.
